最小抑菌濃度(MIC)測定——微量稀釋法
簡介
最小抑菌濃度(Minimum Inhibitory Concentration, MIC)是指能夠抑制微生物生長、繁殖的最低藥物濃度。MIC 測試方法有很多種,常見的測試方法有如下三種:微量稀釋法、瓊脂稀釋法、E-test 法。本次詳細介紹微量稀釋法。
原理
將抗菌藥物與待測微生物在一定的稀釋范圍內進行培養,通常是在每毫升(mL)100 萬個菌落形成單位(CFU)的懸浮濃度時,測定抗菌藥物不同濃度下微生物的生長情況。由于微生物的存在,沒有抗菌活性的測試體系會出現渾濁,而沒有渾濁則表明待測微生物的生長受到了抑制。
用途
測定藥物的最小抑菌濃度,評價藥物的抗菌活性及抑菌能力。
材料與儀器
滅菌陽離子調節培養基 Mueller-Hinton Broth(CAMHB)
待測藥物粉劑、待測菌株、滅菌生理鹽水
滅菌雙蒸水、固體培養基
無菌 V 型 / U 型底 96 孔培養板
麥氏濁度儀、滅菌塑料比濁試管
多道移液器
步驟
1. 提前將待測菌株接種于相應固體培養平板上,于 37 ℃ 細菌培養箱中過夜培養。
2. 分別稱取適量待測抗菌藥物粉劑,加滅菌雙蒸水充分溶解,配制成貯存液備用。
3. 按實驗需求,使用 CAMHB 液體培養基稀釋貯存液至最高待測藥物濃度,取無菌 96 孔板,在生物安全柜中進行藥物稀釋,具體操作為:
第一孔(A1)加入 200 μL 最高待測濃度藥物,A2~A12 孔加入 100 μL CAMHB 液體培養基,隨后從 A1 孔吸出 100 μL 加入 A2 孔,混勻后再從 A2 孔吸出 100 μL 加入 A3 孔,以此類推梯度稀釋到 A12 孔,并舍棄最后 100 μL 稀釋后的液體。
4. 在透明塑料試管中加入 1 mL 滅菌生理鹽水;置于濁度儀上調零,隨后挑取待測菌株充分溶于生理鹽水,震蕩混勻,調整濁度于 0.4~0.6 麥氏濁度(MCF)之間,繼續用滅菌生理鹽水稀釋 20 倍備用。
5. 將 10 μL 稀釋后的菌懸液依次加入每個濃度的藥物孔(A1~A12)中;將 96 孔板置于 37 ℃ 細菌培養箱中培養 16~18 h。
6. 讀取沒有細菌生長的最低藥物濃度,即為該細菌對該藥物的最小抑菌濃度(MIC)。
7. 藥敏試驗以大腸埃希菌 ATCC25922 等標準菌株作為質控菌株,藥敏判斷標準參照 CLSI、EUCAST 指南。
注意事項
1. 每次實驗時應根據待測菌的不同而分別選用:金黃色葡萄球菌 ATCC25923、大腸埃希菌 ATCC25922、糞腸球菌 ATCC29212 和銅綠假單胞菌 ATCC27853 等標準菌株在同一試驗條件下作平行試驗,常用抗菌藥物對這些標準菌株的 MIC 應在預期值范圍內。
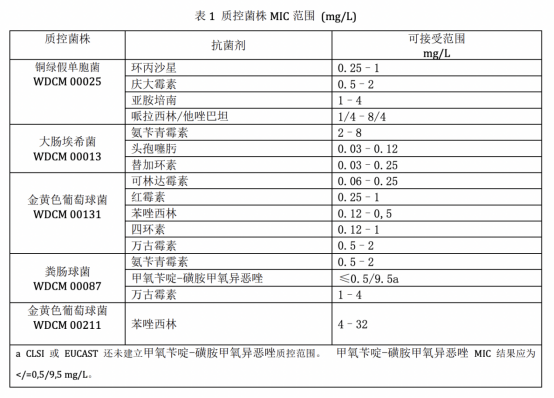
表 1 質控菌株 MIC 范圍 (mg/L)
2. 培養基要求是適合微生物生長,有些微生物對培養基中的成分有特殊的要求,要用特殊的培養基才能進行藥敏試驗:例如,流感嗜血桿菌的藥敏試驗培養基用 HTM 瓊脂;淋球菌的藥敏試驗培養基用加 5% 羊血的巧克力 MH 瓊脂;肺炎鏈球菌的藥敏試驗用 MH 加 5% 的脫纖維羊血培養基。
3. 不同抗生素的穩定性不同,抗生素貯存液最好現配現用,或低溫保存,若出現明顯的狀態變化,應重新配置。
4. 某些特殊藥物需要根據藥物性質預處理培養基以消除拮抗成分;如頭孢地爾的藥敏試驗使用去除鐵離子的 CAMHB。
常見問題
質控組的 MIC 不在預期范圍內稱為失控,常見的影響 MIC 測定結果的因素如下:
(1)培養基:培養基的 pH、滲透壓及電解質對 MIC 有影響;
(2)抗菌藥物:抗菌藥物必須采用標準粉劑。配好的藥物原液應在有效期內使用;
(3)結果觀察時間:大部分微生物在 12~18 h 觀察,有的病原微生物在 20~24 h 觀察。培養時間過長,被輕度抑制的部分病原菌可重新開始生長;另外由于某些抗菌藥物不夠穩定,培養時間過長使其抗菌活性降低,甚至消失,從而使 MIC 值增高。


